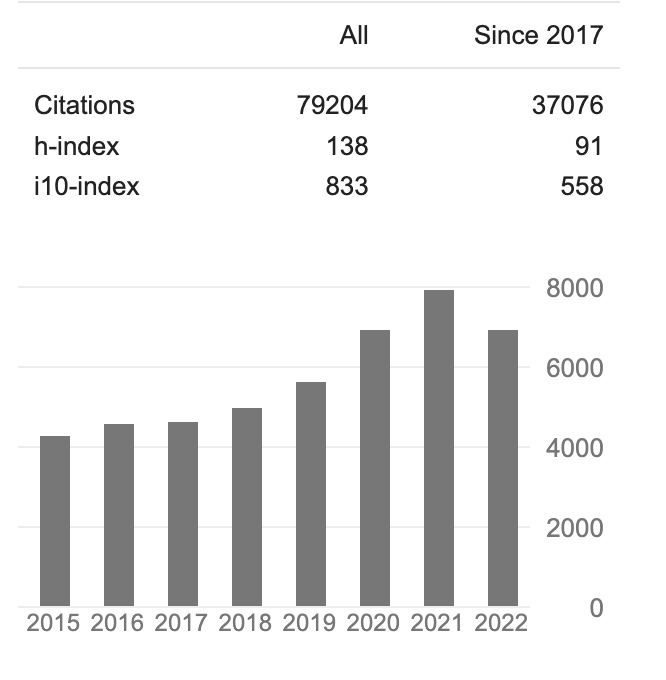
「熊言熊语」这个名字来自于我2020年初开始做的一档音频播客节目。那段时间是我读博即将进入尾声。不难想到「熊言熊语」自然是借了「自言自语」这个词再加上「思考问题的熊」这个ID。 彼时,我强迫自己说话和表达,一方面是因为长时间的密闭空间生活让我的表达欲丧失殆尽,另一方面是博士尾声面临的迷茫和困惑让我无法正常思考。这个播客节目虽然在录制了30期之后目前处于停更状态,但自那以后我幸好还能着时不时输出一些什么。 如今,作为一个渺小的个体,无论面对怎样的生活和环境,你我都应该保留思考的能力,保留表达的能力。就像我前几天那篇推送中写到的:无论怎样,都要找到一种和这个世界沟通的方式。 也许,能做的不多,但,多少能做点什么。 好了,进入正题。 Nature Reviews Cancer 11月24日在线发表了一篇看题目挺「唬人」的Perspective文章:未来10年肿瘤精准治疗的六个未解之谜。 文章的共同一作是德国亥姆霍兹国家研究中心的Adam Wahida 和德国海德堡国家肿瘤疾病中心的 Lars Buschhorn,通讯作者是肿瘤精准治疗领域内的资深大佬Razelle Kurzrock。 Razelle Kurzrock 曾供职过多家不同的机构。在学术研究层面,她Google学术中的H-index高达119,i10-index高达833(国内肺癌领域大佬吴一龙教授H-index为101,i10-index为391;作为学术民工笔者自己读博至今H-index则为他们的零头8),被引用接近8万次。 据说最新online的这篇文章预定了2023 年 1 月出版的印刷版的封面。接下里就让我们一起来了解一下这六个谜题。 精准治疗的关键是必须为每个病人在肿瘤的正确阶段使用正确的药物组合。作者首先使用了伊马替尼治疗慢性粒细胞白血病的例子作为说明。关于伊马替尼,你可以阅读我们之前的文章XXXX。 克服慢性粒细胞白血病有三个关键组成部分。首先是发现了异常的BCR-ABL融合基因;第二个是专门抑制BCR-ABL的药物伊马替尼研发成功使得其可以靶向BCR-ABL突变的白血病细胞而不会杀死依赖其他激酶的正常细胞。 精准治疗的关键是为每个病人在肿瘤的正确阶段使用正确的药物组合。作者使用伊马替尼治疗慢性粒细胞白血病的例子作为说明(关于伊马替尼可以阅读之前的文章熊说肿瘤|跨越60年的癌症靶向治疗里程碑)。 克服慢性粒细胞白血病有三个关键组成部分。首先是发现了异常的BCR-ABL融合基因;第二个是专门抑制BCR-ABL的药物伊马替尼研发成功使得其可以靶向BCR-ABL突变的白血病细胞而不影响依赖其他激酶的正常细胞。 对于确定分子驱动因素和对应靶向药物这两点很多实体瘤中已经取得了一些成功,例如我们熟知的EGFR、ALK、RET和NTRK抑制等等。 但问题在于这些药物的应用虽然对患者的生存结果改善效果远不及伊马替尼。例如ALK重排是肺癌重要驱动因素,然而ALK抑制剂肺癌中有效率约为55%,中位时间为7个月,与在CML中使用BCR-ABL抑制剂的效果相差很多。 虽然这种差异可以被理解为血液瘤和实体瘤的不同。但如果假设两者没有本质区别时,其真正缺少的是第三个因素:治疗时机。 有研究显示,伊马替尼应用于晚期CML增殖转化阶段其反应率约为10%,中位生存期约为1年,疗效不好的原因是因为肿瘤发生了克隆进化后,虽然BCR-ABL仍然是驱动因素但出现了其他分子变异的共同驱动。 在肿瘤发展早期发生复杂克隆演变之前来进行治疗,可能是提高实体癌靶向治疗效果的关键。因此对肿瘤的分子遗传变异的分析应被视为所有癌症患者的一线策略以确保早期和准确的治疗:我们需要在正确的时间为正确的病人提供正确的药物。 不过我们也要认识到一个事实,大多数实体肿瘤都会涉及多个驱动的共突变,其中一些就可能在肿瘤发生的早期。此外,一些功能丧失类型突变药物本身也很难针对其发挥作用。 体细胞突变可以使正常细胞转化为癌细胞,细胞通过克隆选择过程获得了肿瘤特征。例如结直肠癌中的腺瘤性息肉就是典型的例子,恶性腺瘤的进展始于APC的突变,在几个获得性致癌基因打击后完全转变为恶性肿瘤。多种获得性突变最终导致了癌细胞的各种异常特征,如异常增殖、逃避细胞死亡、血管生成和组织侵袭。 但随着NGS相关研究的增加,出乎意料的是有害的基因变异其实也可以在非恶性肿瘤中看到,这就混淆了在治疗恶性肿瘤时应针对哪些分子特征进行判断。如下图所示,几乎没有转化风险的子宫内膜异位症往往带有典型的致癌基因的驱动突变,包括ARID1A、PIK3CA、KRAS等。 此外,反向克隆选择的现象(突变基因的等位基因频率在恶性进展过程中下降)在某些情况下也会发生。BRAF V600E 突变是大约50%的黑色素瘤和许多其它肿瘤的标志,但令人困惑的是在约80%的良性痣中也发现了这些突变,而它们的癌变风险可以忽略不计。此外,虽然HER2在乳腺癌中的过表达贯穿了良性到恶性的转变过程,但在良性肿瘤的导管原位癌(27-56%)的检测频率也要高于浸润性乳腺癌(11-20%)。 肿瘤精准治疗的另一个关键问题是特定基因组改变在多大程度上存在于特定组织中并影响其生长,且tissue-agnostic的治疗方法是否有效。 同样是BRAF V600E 突变在黑色素瘤可以成功地用BRAF抑制剂进行治疗。然而,有研究发现在BRAF突变的结直肠癌中,由于EGFR介导的MAPK途径重新激活,除了BRAF抑制剂外还需要EGFR抑制剂的联合治疗才可以。 另外,BCR-ABL作为CML的标志在其他癌症中很少发现,但最近一例BCR-AB L阳性的胶质母细胞瘤及其用伊马替尼成功治疗的报道表明也同样有可能获益。 肿瘤重要的特征之一是克隆演化,治疗后的克隆生长是复发和耐药的主要原因,也是一个重要的治疗挑战。 从精准治疗角度看,通过基因组检测确定的所谓可及性靶点往往仅存在于一部分肿瘤亚克隆中。bulk 测序中发现的基因组变异可能与肿瘤的某些部分不相关,靶向治疗可预期的疗效也就更值得关注。 因此,治疗效果可能很大程度上取决于在避免相关毒副作用的同时有多少克隆可以被一次性锁定。单细胞测序和多个转移部位的液体活检是一个未来的DNA基因组测序方向。 在一个由许多克隆组成的肿瘤中,以一个克隆为目标对姐妹克隆产生的后果尚不清楚。 如下图所示,我们可以想象临床上某一个可靶向的肿瘤克隆被消灭后,其它克隆之间对氧气或营养的竞争就会得到缓解,进而可能会加速其它非靶向克隆的生长,加速整个肿瘤的生长。 这种混合反应是精准治疗的又一个重要难题,对此也许可以设计出可能的干预措施。比如,共同靶向那些被认为不受致癌突变影响通路的野生型蛋白,以提高对整个肿瘤的生存压力。 研究证明,饮食、生活方式、肠道微生物和对细菌病毒的接触、性别、以及病人的地理和种族都会影响癌症的治疗反应和独特的分子特征。为了用个性化的、更优化的精准治疗来治疗病人,必须考虑到这些因素。 过去十年中,微生物菌群作为一个关键的瘤外变量引起了大家的注意。尽管将特定微生物群种类与表型联系起来的功能研究仍然不多,但已有一些有趣的临床可及研究。比如肠道微生物可以改变荷尔蒙代谢从而调节前列腺癌的演变和疗效。 尽管以前很多肿瘤由于大量基因组变异而被认为无法用传统靶向疗法治疗,但它们最有可能对免疫检查点抑制剂产生反应,甚至可以在原本难治的患者中出现持久的完全缓解。 虽然TMB和PDL1的高表达在临床决策中的重要性越来越大,但是目前还存在非常多的问题。 高TMB肿瘤反应背后的生物学原理可能是只有通过利用使免疫系统失活的检查点才能存在多种突变,一旦用抑制剂阻断免疫系统就会被重新唤醒。此外,高TMB肿瘤可能会呈现更多的突变衍生新抗原,从而增加肿瘤免疫原性。但突变产生的新抗原必须具有免疫原性是由突变特征和免疫反应性共同决定的。 此外,关于免疫和其他治疗如靶向治疗的联合,更加有效的生物标志物,以及在肿瘤早期治疗中何时引入,都还有非常多需要解决的问题。 以上,就是这篇文章中提到未来10年肿瘤精准治疗需要解决的6个问题。就写到这里,我们下次再见。 本文作者:思考问题的熊 版权声明:本博客所有文章除特别声明外,均采用 知识共享署名-非商业性使用-禁止演绎 4.0 国际许可协议 (CC BY-NC-ND 4.0) 进行许可。 如果你对这篇文章感兴趣,欢迎通过邮箱或者微信订阅我的 「熊言熊语」会员通讯,我将第一时间与你分享肿瘤生物医药领域最新行业研究进展和我的所思所学所想,点此链接即可进行免费订阅。写在前面
未来10年肿瘤精准治疗的6个未解之谜

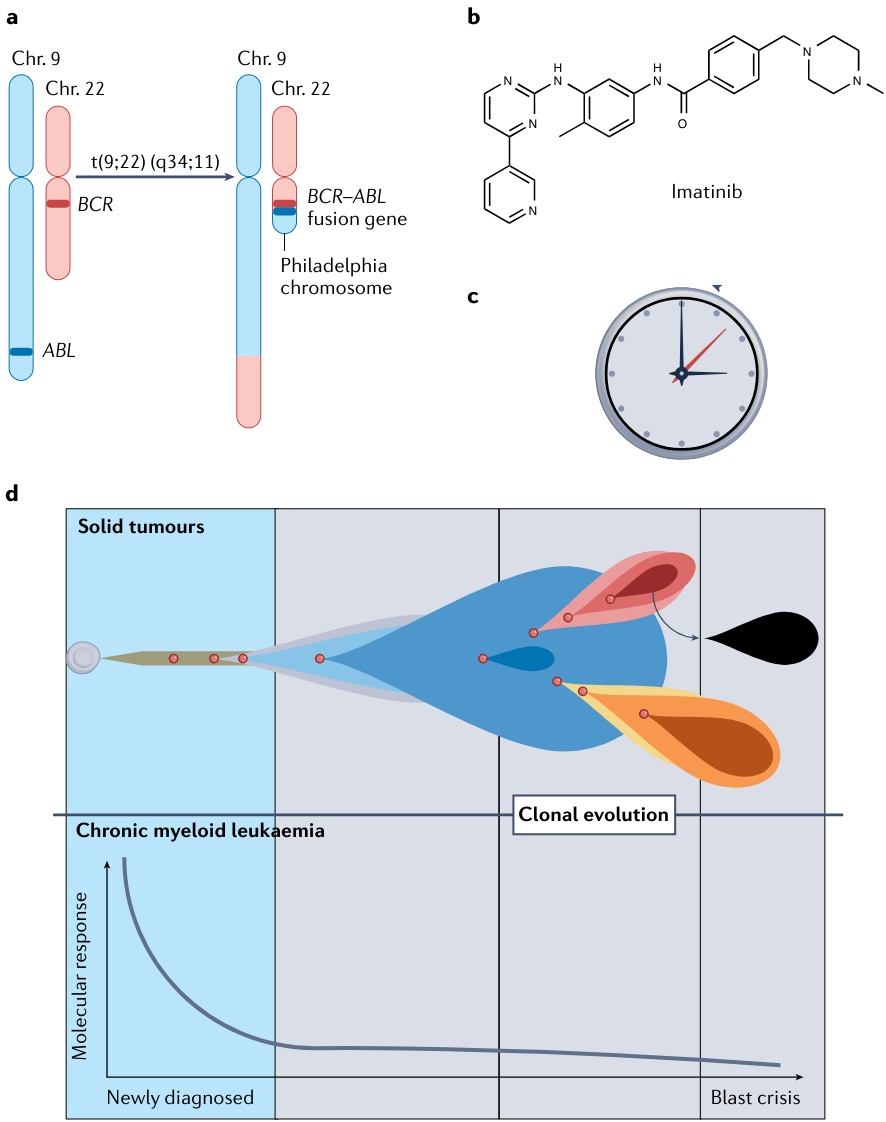
在德州大学安德森癌症中心期间,她创立主持了知名的 Phase I Clinical Trials Program。在UCSD(University of California San Diego)领导了利用分子特征开展个性化治疗 的 I-PREDICT 研究(Nature Medicine, 2019)。谜题一:是否和时间有关

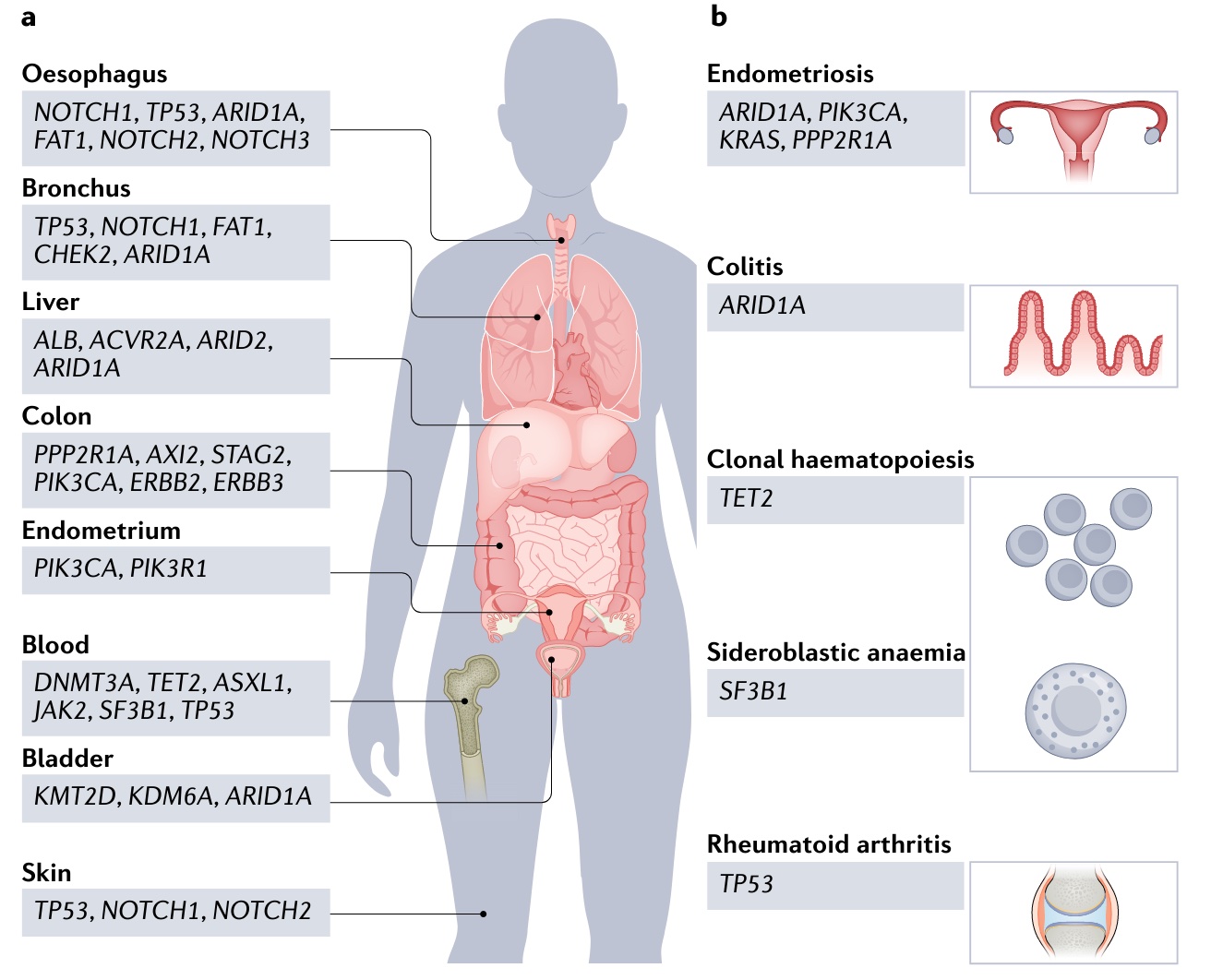
谜题二:有害突变何时致病

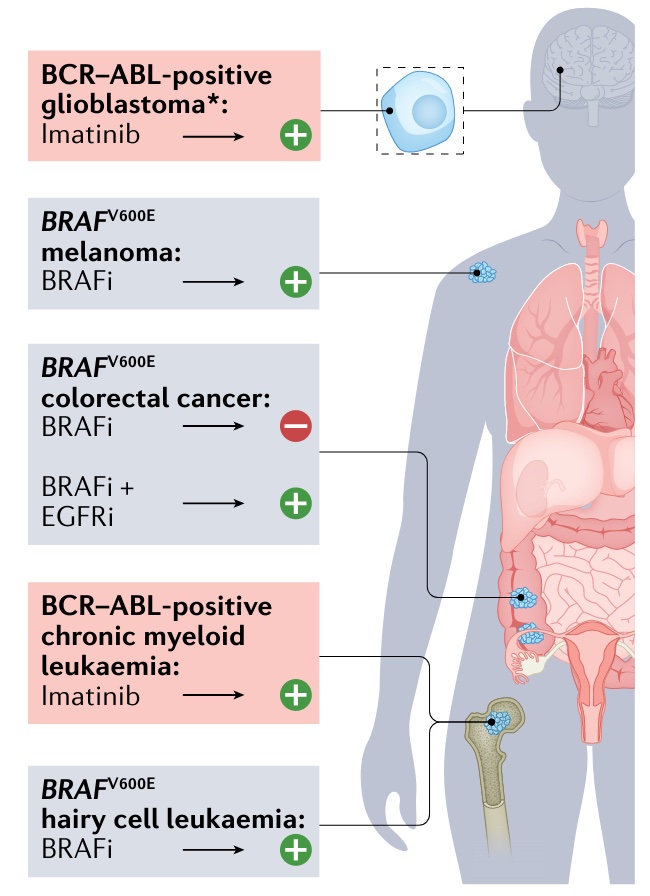
谜题三:突变是否具有组织偏好

谜题四:应该靶向哪个肿瘤克隆

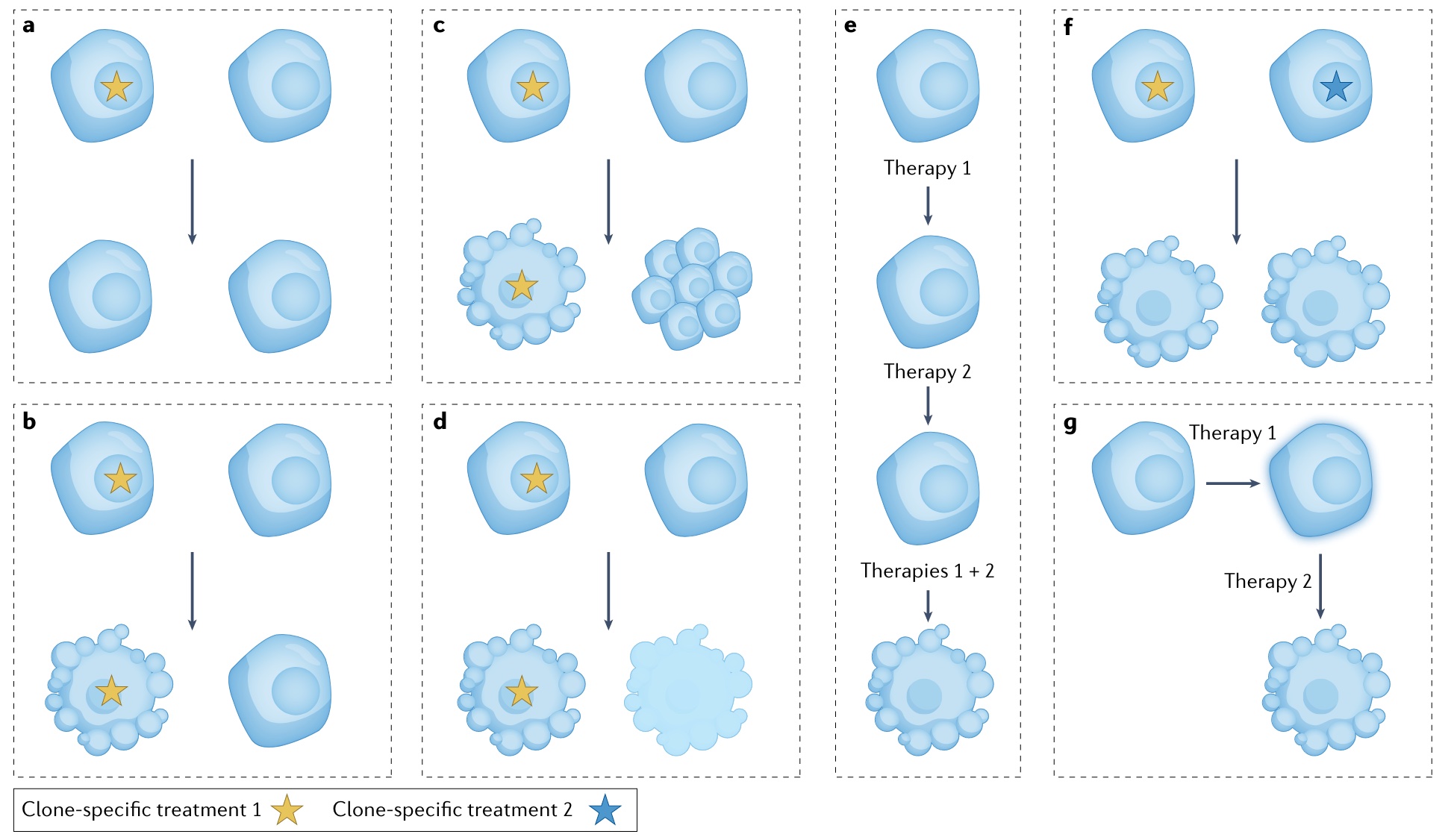
谜题五:肿瘤科医生应该多了解他们的患者


谜题六:何时进行免疫治疗


· 分享链接 https://kaopubear.top/blog/2022-11-28-the-coming-decade-in-precision-oncology-six-riddles/